Inhalte
Chronisches Fatigue Syndrom
Das chronische Fatigue Syndrom (CFS) bezeichnet eine unerklärte krankhafte Erschöpfung über mehr als sechs Monate im Zusammenhang mit sogenannten Core Symptomen, wie zum Beispiel einer reduzierten Fähigkeit zur Durchführung von vorher alltäglichen Aktivitäten (König et al. 2021). Des Weiteren wird es mit Abnormalitäten des zentralen und autonomen Nervensystems, Dysregulation des Immunsystems und gestörtem Metabolismus in Verbindung gebracht (Komaroff und Lipkin 2021). CFS ist bereits seit über 200 Jahren bekannt und tritt häufig nach Infektionskrankheiten auf. Insgesamt betrifft es ungefähr eine von 100 Personen in der medizinischen Primärversorgung (Lim et al. 2020), wobei Mirin et al. (2022) davon ausgehen, dass die Prävalenz von CFS aufgrund der Covid-19 Pandemie, bezogen auf die USA, um ein drei- bis sechsfaches ansteigen wird.
Eine Diagnose von CFS ist derzeit allerdings bedingt möglich, da es keinen Konsens der Diagnostik gibt (WHO 2024).
Zusammenhang zwischen Long-Covid und dem CFS
Long Covid bzw. Post Covid beschreibt das Anhalten von Symptomen über Wochen und Monate unabhängig vom viralen Infektionsstatus (Raveendran et al. 2021). Long Covid wird mit schwachen Antikörperreaktionen in Verbindung gebracht. Insbesondere Frauen sind öfter betroffen und auch Komorbiditäten scheinen eine wichtige Rolle zu spielen (García-Abellán et al. 2021).
Long Covid lässt sich durch aktuelle Forschungsergebnisse vom CFS abgrenzen. Obwohl bei Long Covid und CFS die Symptome nahezu identisch sind, konnte ein immunologischer Unterschied ermittelt werden (Semmler et al. 2023).
Multimodaler Therapieansatz
Herausfordernd ist bei dem CFS nicht allein die langanhaltende Dauer mit Symptomen, teilweise 12 Monate nach Primärerkrankung (Alkodaymi et al. 2022), sondern auch die Vielfältigkeit der möglichen Beschwerden (Soriano et al. 2022). Diese führen zu multimodalen Therapieansätzen aus unterschiedlichen Fachbereichen, wozu Ansätze aus der Pulmologie mit Behandlung von Atembeschwerden (McNarry et al. 2022; Del Corral et al. 2023), der Neuropsychologie zum Ausgleich von neuropsychiatrischen Symptomen (Rolin et al. 2022), oder den Sportwissenschaften mit unterschiedlichen Trainingstherapien (Cavigli et al. 2022; McNarry et al. 2022; Jimeno-Almazán et al. 2023). Unterdessen gibt es neben den konservativen Therapien auch medikamentöse Therapieansätze, wie Antihistaminika (Mashauri 2023; Pinto et al. 2022) oder Vitamin-D-Supplementation (Barrea et al. 2022). Insbesondere bei CFS-Symptomen im Zusammenhang mit Covid-19 bewirken Wirkstoffe wie Nattokinase (Tanikawa et al. 2022) eine deutliche Linderung der Symptome im Alltag.
Generelle Bewegung
Larun et al. (2019) beschreiben, dass aktives Training einen positiveren Effekt auf die Symptomatik von CFS zu haben scheint als alleinige passive Behandlungsansätze. Empfohlen werden in diesem Zusammenhang vor allem Aerobic-Sportarten, wie Walking, Schwimmen, Fahrradfahren und Tanzen. Auch Coscia et al. (2023) empfehlen aktive Übungsprogramme, beziehen ihre Empfehlung dabei aber gezielt auf die Fatigue-Symptomatik nach einer Covid-19-Infektion. In diesem Kontext wird eine Kombination aus Aerobic- und Krafttraining empfohlen, wobei die Autoren betonen, dass das Trainingsprogramm sehr individuell an den Patienten und seine Symptomatik angepasst werden muss und dass eine ständige Überwachung des Trainings durch geschultes Personal erfolgen sollte. Zusätzlich weisen die Autoren darauf hin, dass die meisten Patienten die Dauer und Intensität ihrer Fatigue-Symptomatik zwar durch gezieltes Training verbessern können, dass einige Patienten jedoch auch keine Vorteile aus dem Training ziehen können.
Die Analyse von Larun et al. (2017) kam zu dem Ergebnis, dass mithilfe von Bewegungstherapie bei Patienten mit CFS positive Effekte, insbesondere in Bezug auf die verbesserte Befindlichkeit und geringere Erschöpfung, festgestellt werden konnte. Die Autoren betonen, dass es keine Anzeichen für eine Verschlechterung während der Anwendung dieser Therapiemöglichkeit gibt. Zudem scheint nach Larun et al. (2017) die Wirkungsweise dieser Therapie den Ergebnissen der kognitiven Verhaltenstherapie (Yancey & Thomas 2012) zu ähneln, während die Effekte der Bewegungstherapie größer zu sein scheinen, als die der Pacing-Methode (s.u.).
Besonderheit HIIT und REHIT Training
Kujawski et al. (2021) beschreiben, dass high-intensity-interval-training (HIIT) zwar positive Effekte auf die mitochondriale Funktion und somit auf CFS hat, jedoch eine progrediente Belastungssteigerung in Form von Pacing durchgeführt werden sollte. Wobei Patienten ohne CFS auf hohe Belastungen wie HIIT generell positiv reagieren, können Patienten mit CFS bei zu hoher Einstiegsintensität eine negative Reaktion in Form von erhöhter Fatigue-Symptomatik zeigen.
Auch wenn bisher noch keine Studien zu den direkten Auswirkungen auf CFS existieren, könnte das reduced-exertion high-intensity interval training (REHIT) eine Möglichkeit des Einstiegs bei Patienten mit CFS darstellen. Bei REHIT wird von ähnlichen Auswirkungen auf die mitochondriale Funktion wie bei HIIT, mit jedoch verringerte Fatigue-Symptomatik nach der Belastung berichtet (Metcalfe et al., 2024).
Pacing
In der Trainingstherapie wird der Ansatz verfolgt, mittels der Graded Exercise Therapy (GET) die Belastungstoleranz der Patienten wieder zu erhöhen (White & Etherington 2021; Smakowski et al. 2021). Die Meinungen zum Nutzen und den Risiken von GET sind in der Wissenschaft jedoch umstritten (Vink und Vink-Niese 2020; Vink et al. 2023). Das „Pacing“ stellt hier eine geeignete Methode dar, um die Belastungsgrenzen der Patienten einzuschätzen und ein „post exertional malaise (PEM)“ während GET zu vermeiden (Casson et al. 2023). Dies ist essentiell, da es neben der akuten Verschlechterung der Symptome auch den Krankheitsverlauf verlängert (Ghali et al. 2023). Ausgelöst wird PEM durch eine physische oder psychische Überbelastung (Renz-Polster & Scheibenbogen 2022).
In der Metaanalyse von Sanal-Hayes et al. (2023) (Abbildung 2) wird allerdings aufgezeigt, dass eine Vielzahl von Protokollen diesbezüglich jedoch bis dato mit unterschiedlichen Methoden zur Verfügung stehen. Insgesamt zeigten 11 der 17 Studien einen Benefit, vier Studien konnten keine Wirkung nachweisen und weitere zwei Studien zeigten einen negativen Effekt im Vergleich zur Kontrollgruppe (Sanal-Hayes et al. 2023). Eine nach der Metaanalyse veröffentlichte Studie zeigte, anhand eines standardisierten Protokolls, dem „World Health Organization (WHO) Borg CR-10 5-phase pacing protocol“ einen positiven Einfluss auf das physikalische Aktivitätslevel (Parker et al. 2023).
Abbildung 2:
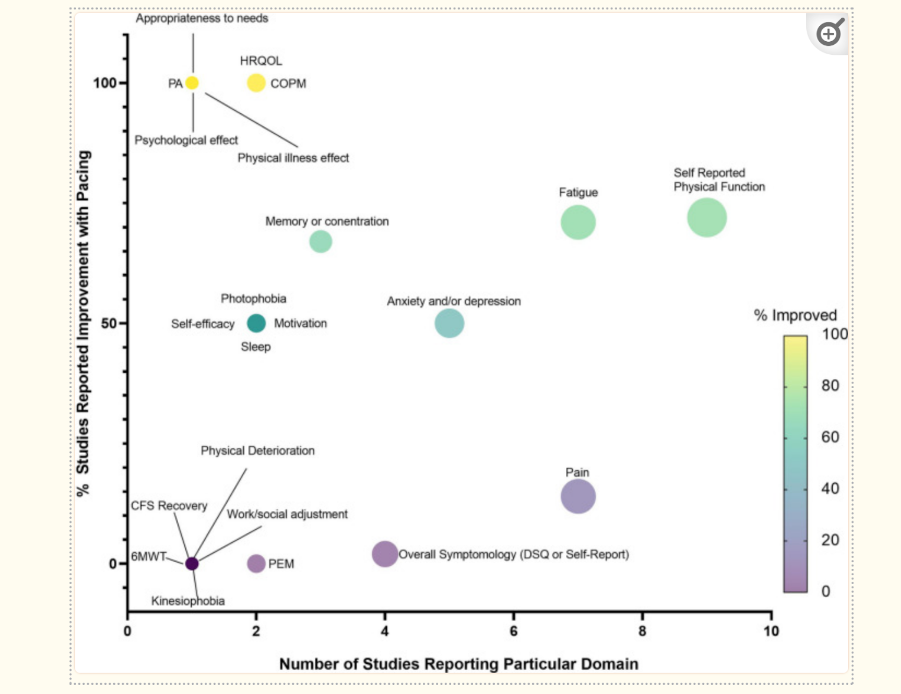
Zusammenfassend scheint es eine Heterogenität in Protokollen bezüglich der „Pacing-Strategie“ bei CFS zu geben, die jedoch in Relation im Einzelnen oft positive Auswirkungen auf das Krankheitsbild zeigen.
Pharmakotherapie
Obwohl die Pharmakotherapie bei CFS weiterhin ein aktives Forschungsfeld ist, gibt es derzeit keine ausreichenden Belege, die eine bestimmte medikamentöse Behandlung als wirksam auszeichnen. Viele Ansätze in der Pharmakotherapie konzentrieren sich auf symptomatische Linderung, etwa durch den Einsatz von Antidepressiva zur Behandlung begleitender depressiver Symptome oder Schlafstörungen. Ein vielversprechendes Forschungsgebiet in der Behandlung des CFS richtet sich auf die mitochondriale Funktion. Frühe Untersuchungen legen nahe, dass Störungen in der mitochondrialen Dynamik und Energieproduktion möglicherweise zentrale Faktoren im Pathomechanismus des CFS darstellen. Interventionen, die darauf abzielen, die mitochondriale Effizienz zu verbessern, könnten daher potenziell therapeutisch wirksam sein, bedürfen jedoch weiterer umfangreicher Untersuchungen (Noor et al., 2021; Vermeulen et al., 2021).
Aktivitätssteuerungsinterventionen
Die Autoren Casson et al. (2023) untersuchten in ihrer Studie, inwiefern der Einsatz von Aktivitätssteuerungsinterventionen eine Verbesserung im Hinblick auf die Erschöpfung, die körperliche Funktion, die psychologische Belastung, die Depression und Angst bei Menschen mit CFS hervorrufen kann. Sie kamen zu dem Ergebnis, dass die Aktivitätssteuerungsinterventionen wirksam bei der Reduzierung von Erschöpfung und psychologischer Belastung sind und darüber hinaus die Verbesserung der körperlichen Funktion bei CFS induziert, insbesondere wenn die Menschen ermutigt werden, ihre Aktivitäten allmählich zu steigern.
Atemtrainings
Ein häufiges Symptom von Long Covid ist Dyspnoe. Um diesem entgegenzuwirken, wurden verschiedene Atemtrainings getestet und als Heimtherapie angewendet. Trainings der Atemmuskulatur führte zu klinisch bedeutenden Verbesserungen der Scores der Fragebögen K-BILD (King’s Brief Interstitial Lung Disease) und des TDI (Transition Dyspnoea Index), sowie der anaeroben Fitness (McNarry et al. 2022). Das Training, ausschließlich der Inspiration, erfolgte mittels eines Atemwiderstandes, welcher mit Hilfe eines vom Patienten in der Hand gehaltenen Gerätes (PrO2FIT Health, USA) erzeugt wurde. Die Intervention erfolgte über acht Wochen an jeweils drei Wochentagen. Pro Training erfolgten sechs Sets mit jeweils sechs Wiederholungen (McNarry et al. 2022). In der Studie von Del Corral et al. (2023). zeigte sich, dass sich durch Training der Inspiration mittels Atemwiderstands die Quality of Life, die Leistungsfähigkeit der Atemmuskulatur und die Peak Force der unteren Extremitäten signifikant verbessert haben.
Auf Grundlage der Literatur bietet sich Atemwiderstandstraining als Therapie bzw. Heimtherapie an. Mögliche kardiale Pathologien müssen aber im Vorfeld ausgeschlossen werden.






Hinterlasse einen Kommentar